-

サイト内検索
細胞情報学分野は2014年1月に開設され、リン酸化を中心とした翻訳後修飾や新規セカンドメッセンジャーなどによる様々な細胞内シグナル伝達システムの解明を目指しています。これらの解明を進めるために、プロテオミクスをはじめ、イメージングや相互作用解析などの種々の技術を開発・導入しています。現在は特に疾患の原因となるタンパク質キナーゼの標的基質群の大規模同定と生理・病理機能の解明を多くの共同研究者の方々と進めています。
News
2020年10月1日より吉川治孝先生が助教に着任しました。

日本プロテオーム学会2019年大会・第70回日本電気泳動学会総会 合同大会にて小迫が口頭発表を行いました。
題目は「Phos-tagと質量分析によるリン酸化シグナル伝達機構の解明」です。
(参考)
パーキンソン病の原因遺伝子産物Parkinの活性化がMITOLによって開始されることを明らかにした東京都医学総合研究所との共同研究がJournal of Biological Chemistryに掲載されました。題目は「Parkin recruitment to impaired mitochondria for nonselective ubiquitylation is facilitated by MITOL」です。
Keystone meeting(ストックホルム)にて小迫が口頭発表とポスター発表を行いました。 題目は「BioID-Based Screening of Biotinylation Sites Globally Identifies STING Interactors」です。(参考)
リン脂質スクランブラーゼXkr8がリン酸化によって活性制御されることを明らかにした大阪大学長田研究室との共同研究がPNASに掲載されました。
題目は「Phosphorylation-mediated activation of mouse Xkr8 scramblase for phosphatidylserine exposure」です。
第41回日本分子生物学会年会(横浜)にて茂谷がポスター発表を行いました。
題目は「BioID法によるビオチン化部位の大規模スクリーニングで明らかとなったSTINGタンパク質の相互作用因子」です。(参考)
研究テーマ&内容
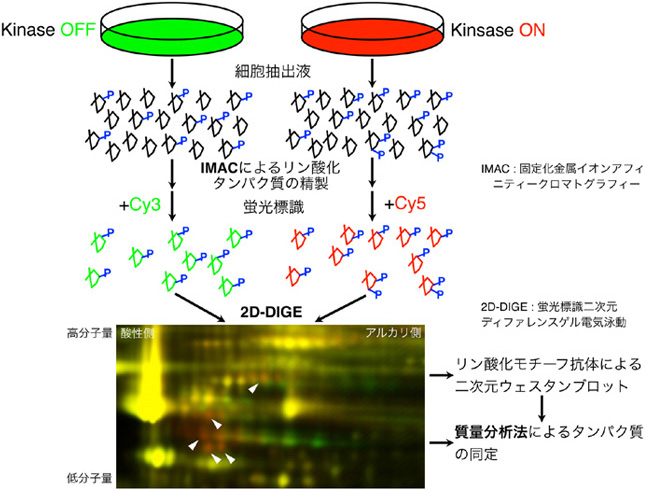
1.リン酸化プロテオーム解析法の開発によるプロテインキナーゼの標的基質の網羅的同定とその生理機能の解析
細胞内において、多くのタンパク質はプロテインキナーゼによるリン酸化とホスファターゼによる脱リン酸化という可逆的な制御を受けている。タンパク質のリン酸化は負電荷と親水性の付与によってタンパク質の酵素活性・局在・安定性・相互作用などをダイナミックに制御することが可能であり、真核生物において最も広範に認められる翻訳後修飾である。このためプロテインキナーゼはヒトの場合で500種類以上と数多く存在し、様々な細胞内情報伝達系で中心的な役割を果たしている。プロテインキナーゼをコードする遺伝子の変異は癌・パーキンソン病・ダウン症候群・心不全などの疾患と深く関連することが知られており、さらに炭疽菌・らい菌・赤痢菌などの多くの病原性細菌が特定のキナーゼを標的にしていることが最近明らかとなった。
個々のキナーゼの生理的・病理的機能を理解し、診断・創薬などの応用研究に役立てるためには、複雑で精緻なリン酸化ネットワークの全貌を解明することが必要である。本研究室ではERK/MAPキナーゼやG蛋白質共役7回膜貫通型受容体キナーゼ(GRK)、およびパーキンソン病の原因遺伝子産物PINK1などをモデルとして、我々が独自に開発しつつあるリン酸化プロテオーム解析法によってその標的基質を網羅的に同定してきた。そして興味深い新規基質のリン酸化の生理的・病理的機能を種々の相互作用解析やイメージング技術を駆使して解明することを目標としている。
2. 新規セカンドメッセンジャーcyclic GMP-AMPによる自然免疫誘導機構
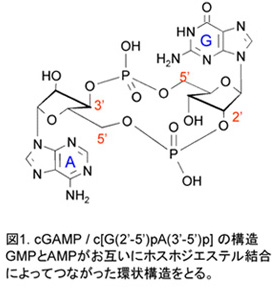 cyclic AMPなどの環状ヌクレオチドは、細胞内情報伝達物質(セカンドメッセンジャー)として生体内で重要な役割を担っているが、我々は最近、非常にユニークな構造をとる新規環状ジヌクレオチドcyclic GMP-AMP (cGAMP)(図1)が哺乳類の生体内に存在する事を見出した。cGAMPは自然免疫シグナルにおいてセカンドメッセンジャーとして働くことが分かってきたが、その詳細な作用機構は不明である。興味深いことに、細菌には多様な生理活性を有する別の環状ジヌクレオチドが存在する。cGAMPの生理作用、特に現在は自然免疫応答における役割に注目した研究を展開しており、哺乳類における環状ジヌクレオチドの生物学的重要性を明らかにすることを目標としている。
cyclic AMPなどの環状ヌクレオチドは、細胞内情報伝達物質(セカンドメッセンジャー)として生体内で重要な役割を担っているが、我々は最近、非常にユニークな構造をとる新規環状ジヌクレオチドcyclic GMP-AMP (cGAMP)(図1)が哺乳類の生体内に存在する事を見出した。cGAMPは自然免疫シグナルにおいてセカンドメッセンジャーとして働くことが分かってきたが、その詳細な作用機構は不明である。興味深いことに、細菌には多様な生理活性を有する別の環状ジヌクレオチドが存在する。cGAMPの生理作用、特に現在は自然免疫応答における役割に注目した研究を展開しており、哺乳類における環状ジヌクレオチドの生物学的重要性を明らかにすることを目標としている。
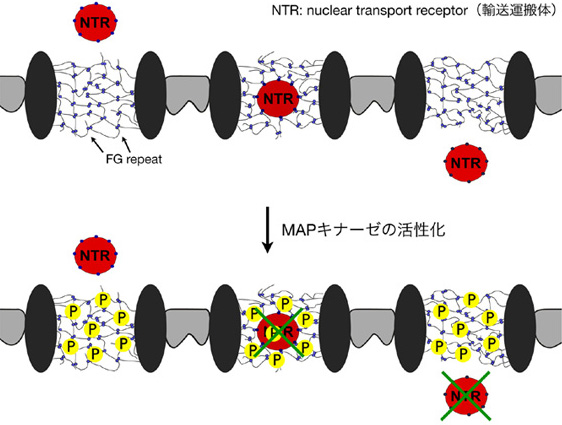
3.核膜孔複合体の翻訳後修飾による核 —細胞質間物質輸送などの細胞機能の制御
ヒトの体内では毎分1kg以上もの物質が細胞質と核の間を行き来きしており、これらは全て核膜を貫通する核膜孔を介して通過している。約40kDa以上のサイズのタンパク質や核酸が通過するためにはインポーティンファミリータンパク質などの輸送運搬体の働きが必要である。この輸送運搬体と核膜孔との相互作用を介した核—細胞質間の選択的物質輸送は、真核生物にとって多様な生理・病理現象に関与する重要な細胞内プロセスの一つであり、核内への薬物送達システムの開発においても大きな課題となっている。しかしながら、細胞内シグナル伝達によるこの輸送経路の制御機構は殆ど明らかにされていない。本研究室では最近、ERK/MAPキナーゼが核膜孔複合体構成因子(ヌクレオポリン)をリン酸化することで輸送運搬体との相互作用を抑制し、核—細胞質間輸送を制御する可能性を示した。現在、リン酸化などの翻訳後修飾による核膜孔複合体の分子認識能の調節機構について、プロテオミクスやイメージングなどの手法を用いて包括的に解明することを目指している。
メンバー紹介 ※スパムメール対策の為、@マークを(@)とさせていただいております。
- 教授
小迫 英尊
(こさこ ひでたか) - Tel:088-634-6413
Email:kosako(@)tokushima-u.ac.jp
- 講師
茂谷 康
(もたに こう) - Tel:088-634-6411
Email:motani(@)tokushima-u.ac.jp
- 助教
吉川 治孝
(よしかわ はるのり) - Tel:088-634-6411
Email:yoshikawa.harunori(@)tokushima-u.ac.jp
- 技術補佐員
河野 恵
(かわの めぐみ) - Tel:088-634-6403
- 技術補佐員
梶本 真弓美
(かじもと まゆみ) - Tel:088-634-6404
- 技術補佐員
岩田 真由美
(いわた まゆみ) - Tel:088-634-6404
発表論文
| ・ | Motani, K., Kosako, H. (2019) Phosphoproteomic identification and functional characterization of protein kinase substrates by 2D-DIGE and Phos-tag PAGE. Biochimica et Biophysica Acta (BBA). 1867, 57-61. |
|---|---|
| ・ | Terabayashi, T., Hanada, K,. Motani, K., Kosako, H,. Yamaoka, M,. Kimura, T,. Ishizaki, T. (2018) Baicalein disturbs the morphological plasticity and motility of breast adenocarcinoma cells depending on the tumor microenvironment. Genes Cells. 23, 466-479. |
| ・ | Motani, K., Kosako, H. (2018) Activation of stimulator of interferon genes (STING) induces ADAM17-mediated shedding of the immune semaphorin SEMA4D. J Biol Chem. 293, 7717-7726. |
| ・ | Sato, M., Sato, K., Tomura, K., Kosako, H., Sato, K. (2018) The autophagy receptor ALLO-1 and the IKKE-1 kinase control clearance of paternal mitochondria in Caenorhabditis elegans. Nature Cell Biol . 20 ,81-91. |
| ・ | Kosako, H., Motani, K. (2017) Global Identification of ERK Substrates by Phosphoproteomics Based on IMAC and 2D-DIGE. Methods Mol Biol. 1487, 137-149. |
| ・ | Ishikawa, E., Kosako, H., Yasuda, T., Ohmuraya, M., Araki, K., Kurosaki, T., Saito, T., Yamasaki, S.* (2016) Protein kinase D regulates positive selection of CD4+ thymocytes through phosphorylation of SHP-1. Nature Commun., 7(12756). |
| ・ | Akabane, S., Uno, U., Tani, N., Shimazaki, S., Ebara, N., Kato, H., Kosako, H., and Oka, T.* (2016) PKA regulates PINK1 stability and Parkin recruitment to damaged mitochondria through phosphorylation of MIC60. Mol. Cell, 62(3), 371-384. |
| ・ | Shindo, Y.*, Iwamoto, K., Mouri, K., Hibino, K., Tomita, M., Kosako, H., Sako, Y. and Takahashi, K.* (2016) Conversion of graded phosphorylation into switch-like nuclear translocation via autoregulatory mechanisms in ERK signalling. Nature Commun., 7(10485). |
| ・ | Motani, K., Ito, S., and Nagata, S.* (2015) DNA-Mediated Cyclic GMP-AMP Synthase-Dependent and -Independent Regulation of Innate Immune Responses. J. Immunol., 194, 4914-4923. |
| ・ | Okatsu, K., Koyano, F., Kimura, M., Kosako, H., Saeki, Y., Tanaka, K.*, and Matsuda,N.* (2015) Phosphorylated ubiquitin chain is the genuine Parkin receptor. J. Cell Biol., 209, 111-128. |
| ・ | Koyano, F., Okatsu, K., Kosako, H .,Tamura, Y., Go, E., Kimura, M., Kimura, Y., Tsuchiya, H., Yoshihara, H., Hirokawa, T., Endo, T., Fon, E. A., Trempe, J.-F., Saeki, Y., Tanaka, K.* and Matsuda, N.* (2014) Ubiquitin is phosphorylated by PINK1 to activate Parkin. Nature, 510, 162-166. |
| ・ | Kawane, K., Motani, K. and Nagata, S.* (2014) DNA degradation and its defects. Cold Spring Harb. Perspect. Biol., doi: 10.1101/cshperspect.a016394. |
| ・ | Tsurumi, H., Harita, Y.*, Kurihara, H., Kosako, H .,Hayashi, K., Matsunaga, A., Kajiho, Y., Kanda, S., Miura, K., Sekine, T., Oka, A., Ishizuka, K., Horita, S., Hattori, M., Hattori, S. and Igarashi, T. (2014) Epithelial protein lost in neoplasm modulates platelet-derived growth factor-mediated adhesion and motility of mesangial cells. Kidney Int., 86, 548-557. |
| ・ | Iguchi, M., Kujuro, Y., Okatsu, K., Koyano, F., Kosako, H .,Kimura, M., Suzuki, N., Uchiyama, S., Tanaka, K.* and Matsuda, N.* (2013) Parkin-catalyzed ubiquitin-ester transfer is triggered by PINK1-dependent phosphorylation. J. Biol. Chem., 288, 22019-22032. |
| ・ | Nakaya, M., Tajima, M., Kosako, H .,Nakaya, T., Hashimoto, A., Watari, K., Nishihara, H., Ohba, M., Komiya, S., Tani, N., Nishida, M., Taniguchi, H., Sato, Y., Matsumoto, M., Tsuda, M., Kuroda, M., Inoue, K. and Kurose, H.* (2013) GRK6 deficiency in mice causes autoimmune disease due to impaired apoptotic cell clearance. Nature Commun., 4(1532), doi: 10.1038/ncomms2540. |
| ・ | Wang, Q., Imamura, R., Motani, K., Kushiyama, H., Nagata, S., Suda, T.* (2013) Pyroptotic cells externalize eat-me and release find-me signals and are efficiently engulfed by macrophages. Int. Immunol., 25, 363-372. |
| ・ | Okatsu, K., Oka, T., Iguchi, M., Imamura, K., Kosako, H .,Tani, N., Kimura, M., Go, E., Koyano, F., Funayama, M., Shiba-Fukushima, K., Sato, S., Shimizu, H., Fukunaga, Y., Taniguchi, H., Komatsu, M., Hattori, N., Mihara, K., Tanaka, K. and Matsuda, N.* (2012) PINK1 autophosphorylation upon membrane potential dissipation is essential for Parkin recruitment to damaged mitochondria. Nature Commun., 3(1016), doi: 10.1038/ncomms2016. |
| ・ | Motani, K., Kushiyama, H., Imamura, R., Kinoshita, T., Nishiuchi, T., Suda, T.* (2011) Caspase-1 induces apoptosis-associated speck-like protein containing a caspase-recruitment domain (ASC)-mediated necrosis independently of its catalytic activity. J. Biol. Chem., 286, 33963-33972. |
| ・ | Tabata, K.*, Sakai, H., Nakajima, R., Saya-Nishimura, R., Motani, K., Okano, S., Shibata, Y., Abiko, Y., Suzuki, T. (2011) Acute application of cisplatin affects methylation status in neuroblastoma cells. Oncol. Rep., 25, 1655-1660. |
| ・ | Kosako, H.*and Nagano, K. (2011) Quantitative phosphoproteomics strategies for understanding protein kinase-mediated signal transduction pathways. Expert Rev. Proteomics, 8, 81-94. |
| ・ | Kosako, H.* and Imamoto, N. (2010) Phosphorylation of nucleoporins: signal transduction-mediated regulation of their interaction with nuclear transport receptors. Nucleus, 1, 309-313. |
| ・ | Motani, K., Kawase, K., Imamura, R., Kinoshita, T., Kushiyama, H., Suda, T.* (2010) Activation of ASC induces apoptosis or necrosis, depending on the cell type, and causes tumor eradication. Cancer Sci., 101, 1822-1827. |
| ・ | Kosako, H.*, Yamaguchi, N., Aranami, C., Ushiyama, M., Kose, S., Imamoto, N., Taniguchi, H., Nishida, E. and Hattori, S. (2009) Phosphoproteomics reveals new ERK MAP kinase targets and links ERK to nucleoporin-mediated nuclear transport. Nature Struct. Mol. Biol., 16, 1026-1035. |
| ・ | Kosako, H.* (2009) Phos-tag Western blotting for detecting stoichiometric protein phosphorylation in cells. Nature Protocols (Protocol Exchange), doi: 10.1038/nprot.2009.170. |
| ・ | Hasegawa, M., Imamura, R., Motani, K., Nishiuchi, T., Matsumoto, N., Kinoshita, T., Suda, T.* (2009) Mechanism and repertoire of ASC-mediated gene expression. J. Immunol., 182, 7655-7662. |
| ・ | Harita, Y., Kurihara, H., Kosako, H.,Tezuka, T., Sekine, T., Igarashi, T., Ohsawa, I., Ohta, S. and Hattori, S.* (2009) Phosphorylation of Nephrin triggers Ca2+ signaling by recruitment and activation of phospholipase C-γ1. J. Biol. Chem., 284, 8951-8962. |
| ・ | Hattori, S.*, Iida, N. and Kosako, H. (2008) Identification of protein kinase substrates by proteomic approaches. Expert Rev. Proteomics, 5, 497-505. |
| ・ | Harita, Y., Kurihara, H., Kosako, H.,Tezuka, T., Sekine, T., Igarashi, T. and Hattori, S.* (2008) Neph1, a component of the kidney slit diaphragm, is tyrosine phosphorylated by the Src family tyrosine kinase and modulates intracellular signaling by binding to Grb2. J. Biol. Chem., 283, 9177-9186. |
| ・ | Motani, K., Tabata, K., Kimura, Y., Okano, S., Shibata, Y., Abiko, Y., Nagai, H., Akihisa, T., Suzuki, T.* (2008) Proteomic analysis of apoptosis induced by xanthoangelol, a major chalcone constituent of Angelica keiskei, in neuroblastoma. Biol. Pharm. Bull., 31, 618-626. |
| ・ | Han, M.Y., Kosako, H.*, Watanabe, T. and Hattori, S. (2007) Extracellular signal-regulated kinase/mitogen-activated protein kinase regulates actin organization and cell motility by phosphorylating the actin cross-linking protein EPLIN. Mol. Cell. Biol., 27, 8190-8204. |
| ・ | Kobayashi, M., Katagiri, T., Kosako, H .,Iida, N. and Hattori, S.* (2007) Global analysis of dynamic changes in lipid raft proteins during T-cell activation. Electrophoresis, 28, 2035-2043. |
| ・ | Machida, M., Kosako, H., Shirakabe, K., Kobayashi, M., Ushiyama, M., Inagawa, J., Hirano, J., Nakano, T., Bando, Y., Nishida, E. and Hattori, S.* (2007) Purification of phosphoproteins by immobilized metal affinity chromatography and its application to phosphoproteome analysis. FEBS J., 274, 1576-1587. |
| ・ | Tabata, K., Motani, K., Takayanagi, N., Nishimura, R., Asami, S., Kimura, Y., Ukiya, M., Hasegawa, D., Akihisa, T., Suzuki, T.* (2005) Xanthoangelol, a major chalcone constituent of Angelica keiskei, induces apoptosis in neuroblastoma and leukemia cells.Biol. Pharm. Bull., 28, 1404-1407. |
| ・ | Ueda, K., Kosako, H.*, Fukui, Y. and Hattori, S.* (2004) Proteomic identification of Bcl2-associated athanogene 2 as a novel MAPK-activated protein kinase 2 substrate. J. Biol. Chem., 279, 41815-41821. |
| ・ | 小迫 英尊 , 茂谷 康 Phos-tagなどのリン酸化プロテオミクス技術による疾患原因キナーゼの機能解析 電気泳動 No.61: pp53-57 (2017) |
| ・ | 新土 優樹 , 小迫 英尊 , 佐光 靖志 , 高橋 恒一 細胞内シグナルのアナログ・デジタル変換 生物物理 No.56: pp334-336 (2016) |
| ・ | 小迫 英尊 タンパク質キナーゼとユビキチンリガーゼの連携によるミトコンドリアの品質管理機構とパーキンソン病 日本応用酵素協会誌 No.50: pp11〜19 (2015) |
| ・ | 小迫 英尊 プロテオミクスで明らかになった核膜孔複合体の翻訳後修飾による機能制御 生化学 Vol.87 No.1: pp49〜55 (2015) |
| ・ | 小迫 英尊 リン酸化プロテオミクスによるキナーゼ基質の大規模解析 生化学 Vol.83 No.12: pp1122〜1127 (2011) |
| ・ | 小迫 英尊 リン酸化プロテオミクスで明らかとなったERKによる核膜孔複合体の機能制御 実験医学 Vol.28 No.1: pp69〜73 (2010) |
| ・ | 小迫 英尊 , 後藤 由季子 タンパク質のリン酸化 朝倉書店「タンパク質の事典」 pp635〜638 (2008) |
| ・ | 小迫 英尊, 牛山 正人, 服部 成介 2D DIGE技術を用いたリン酸化プロテオーム解析によるシグナル伝達経路構成因子の網羅的同定法 実験医学 Vol.22 No.9: pp1299〜1304 (2004) |
最新情報一覧を見る
- すべて
- お知らせ
- 説明会
- セミナー・イベント
- 2023.06.23
- 2023.01.27
- 2022.01.13
- 2021.10.11
- 2021.05.13
- 2021.03.082021年度 共通機器利用申請について
- 2021.02.24
- 2020.10.09
- 2020.06.25【機器情報】正立型二光子レーザー顕微鏡 A1R MP 使用再開について
- 2020.06.09【機器情報】正立型二光子レーザー顕微鏡 A1R MP 使用中止について
- 2023.06.23お知らせ
- 2023.01.27お知らせ
- 2022.01.13お知らせ
- 2021.10.11お知らせ
- 2021.05.13お知らせ
- 2021.02.24お知らせ
- 2020.10.09お知らせ
- 2020.06.25お知らせ【機器情報】正立型二光子レーザー顕微鏡 A1R MP 使用再開について
- 2020.06.09お知らせ【機器情報】正立型二光子レーザー顕微鏡 A1R MP 使用中止について
- 2020.06.05お知らせ利用規則の改訂及び飲食時における様式の追加について
- 2023.06.23説明会
- 2023.01.27説明会
- 2022.01.13説明会
- 2021.10.11説明会
- 2021.03.08説明会2021年度 共通機器利用申請について
- 2020.05.27説明会(改訂)消費税加算による共用機器料金改訂について
- 2020.05.27説明会【重要】BZ-X700について(共用機器より削除)
- 2020.02.10説明会(改訂版)令和2年度 機器利用申請書 様式について
- 2020.02.05説明会【お知らせ】令和2年度 機器利用申請書 様式変更について
- 2020.01.29説明会
- 2018.05.09セミナー・イベント
- 2017.12.15セミナー・イベント第11回発生生物学セミナーを行います。
- 2017.09.01セミナー・イベント第10回発生生物学セミナーを行います。
- 2017.08.21セミナー・イベント第9回発生生物学セミナーを行います。
- 2017.03.02セミナー・イベント第8回初期発生学セミナー開催
- 2017.02.07セミナー・イベント第7回初期発生学セミナー開催
- 2016.12.28セミナー・イベント第6回初期発生学セミナー開催
- 2016.10.04セミナー・イベント第5回初期発生学セミナー開催
- 2014.04.16セミナー・イベント藤井節郎記念医科学センター 開設記念シンポジウムが開催されました









