
-

サイト内検索

分子生命科学分野は、2020年9月に新設された研究室です。私たちは、生体内のシャペロンネットワークに着目し、細胞内タンパク質の恒常性維持のメカニズムを分子レベルから明らかにすることを目指しています。シャペロンは、タンパク質のフォールディング制御だけではなく、タンパク質輸送・分解、または酵素の活性制御や液-液相分離タンパク質の制御など、様々な機能を持ちます。私たちの研究では、核磁気共鳴 (NMR) 法やクライオ電子顕微鏡を用いた構造解析、生化学実験、ツール開発、などを行なっています。
一緒に研究を進めてくれる学部生、大学院生を募集しています。興味のある方は齋尾までご連絡ください。
研究室HP: https://saio-lab.jp
News
新しい研究室HPはこちら (https://saio-lab.jp )です
日時:2022年2月21日(月) 09:00 – 14:00 オンライン開催(Zoom)
申込方法:こちらより登録をお願いいたします。締切日:2022年2月18日(金) 正午
日時:2022年 1月 19日 14:00~16:20
場所: ZOOM
【SPEAKERS】
Prof. Tomomi Tsunematsu (Tohoku University, Japan)
Prof. Young-Ho Lee (Korea Basic Science Institute, Korea)
参加登録・プログラム詳細:
https://us02web.zoom.us/webinar/register/WN_Hq0oZxQZTUqutKqYHp7khA
日程: 2021年12月13日(月)、14日(火)
開催方法: Zoomによるオンラインセミナー
参加登録は、次のリンク先の「参加申し込み」タブよりお申し込みください。
日時: 2021年11月30日 13:00-17:00
場所: ZOOM/フクラシア東京ステーション C会議室 ハイブリッド
参加登録: 下記リンク先より登録をお願いします。(締め切り: 11月29日)
https://us02web.zoom.us/webinar/register/WN_iZxXOwbvTKu3nxJA8NjaOA
募集内容は徳島大学採用情報もしくはJREC-IN Portalをご確認下さい。
研究テーマ&内容
1.タンパク質フォールディングと分子シャペロン −タンパク質社会の医療システム−
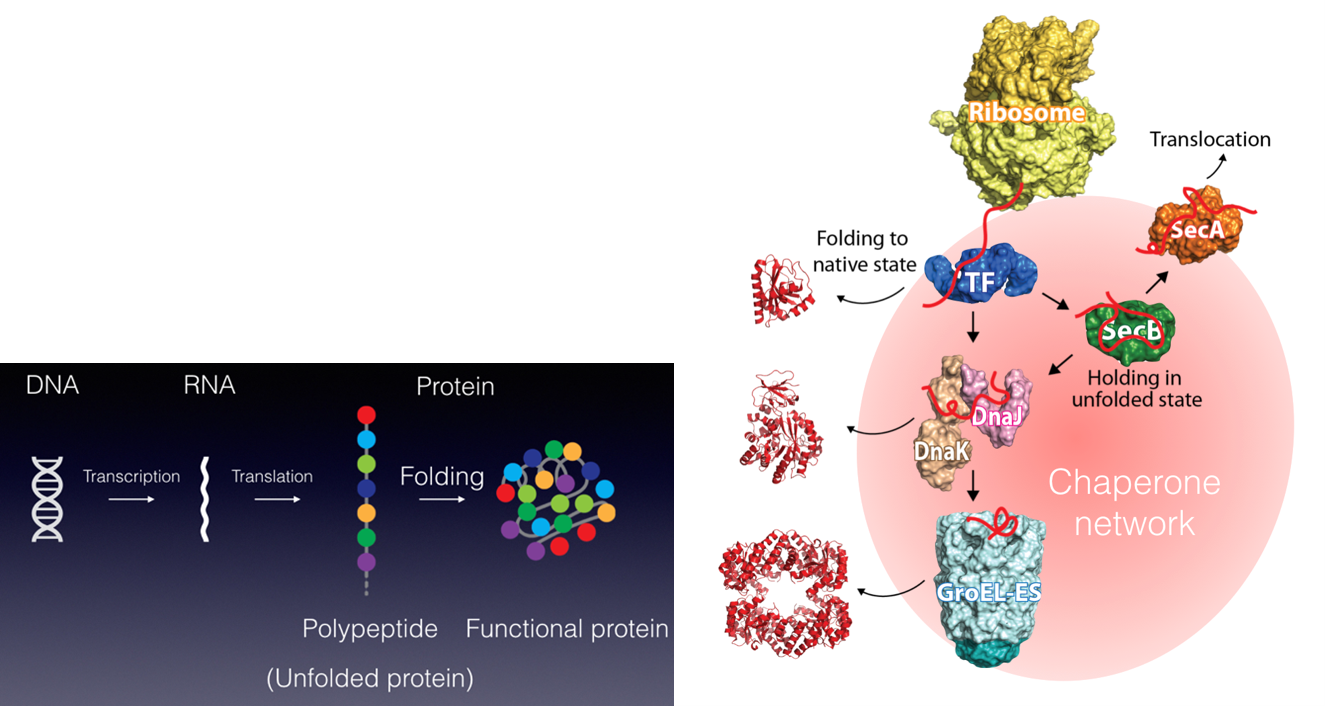
私たちが健康な生活を送るために病院や医療システムがあるように、細胞内のタンパク質が正しく機能するためには分子シャペロンが必須です。さらに、疾患ごとの専門医がいるように、シャペロンにもそれぞれの “専門” があり、複数のシャペロンがそれぞれ固有の機能を発揮することによって、新生タンパク質のフォールディング補助、失活した不良タンパク質の “治療” (再フォールディング) または分解などが行われます。翻訳されたタンパク質の大部分がシャペロンとの相互作用を介して成熟していき、シャペロン分子なしに細胞は生きていくことができません。また、ガン細胞においてはシャペロンの発現量が異常に高まっていたり、反対にシャペロンの機能不全がアルツハイマー病、ALSなどの神経難病の要因となったりと、シャペロンは疾病との関連も深い生体分子の一つです。私たちは、このように多彩な機能を持つシャペロンに注目し、シャペロンがどうやって機能しているのか、そのメカニズムを分子レベルから解明することを目指した研究をしています。
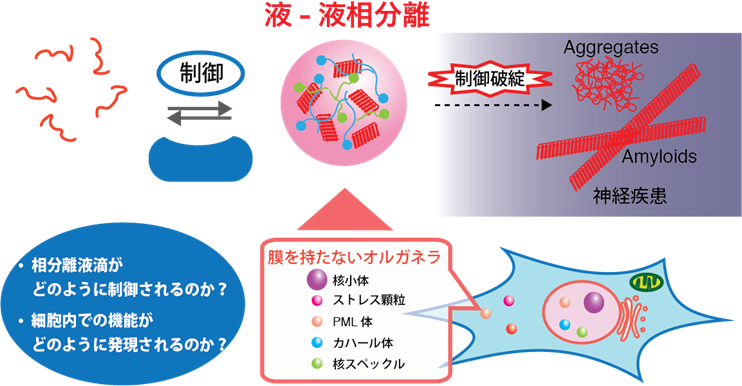
2. 液-液相分離制御のメカニズム −これまで知られていなかったタンパク質の “状態” 制御−
最新の研究によって、細胞内のタンパク質が、不均一な状態であることが明らかになってきています。細胞膜で囲われていなくても、タンパク質の多量体形成を核とした「液-液相分離」によって、区分された液滴領域が形成され、生体反応の”場”が形成されます。この、液-液相分離現象は、私たちの身近なところでは、ドレッシングの油滴などにおいてみられますが、このような現象が、私たちの細胞の中でも起きているのです。液-液相分離は、分子レベルでの現象と、細胞レベルでの機能をつなぐ概念としても注目されていますが、そればかりではなく、液-液相分離という概念は、筋萎縮性側索硬化症 (ALS)や認知症、アルツハイマー病などの神経疾患に対する研究を大きく変えようとしています。従来のアミロイド仮説に加え、液-液相分離の制御破綻と神経疾患の関連が強く示唆されています。私たちは、「相分離の制御と破綻」に注目し、特に相分離の制御因子に対する研究を推進しています。相分離制御因子についての立体構造解析から、相分離という状態がどのように制御されているのかを分子レベルで明らかにするとともに、制御破綻によって疾病が発症するメカニズムを理解します。
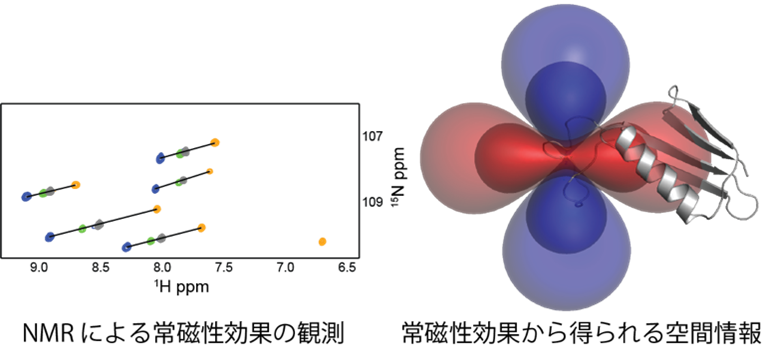
3.タンパク質の動的構造解析法 −新しい計測法から見えてくるタンパク質の本来の姿−
生命における ”分子機械” として、タンパク質はそれぞれ特徴的な立体構造を有し、さらにそれをダイナミックに変化させることによって機能を発揮します。しかし、その構造変化がどの段階で、どのようなタイムスケールで起こるのか、といったタンパク質の “動き” に関する理解はほとんど進んでいません。私たちは、NMRや常磁性ランタノイドイオンなどを用いた戦略によって、タンパク質の立体構造変化を追跡する手法の開発に取り組んでいます。
メンバー紹介 ※スパムメール対策の為、@マークを(@)とさせていただいております。

- 教授
齋尾 智英
(さいお ともひで) - Tel:088-634-6421
Email:saio(@)tokushima-u.ac.jp

- 助教
松﨑 元紀
(まつさき もとのり) - Tel:088-633-9149
Email:matsusaki(@)tokushima-u.ac.jp

- 学術研究員
ZHU HAOJIE(朱 浩傑)
(しゅ こうけつ)

- 技術補佐員
坂本 恵理
(さかもと えり) - Tel:088-633-9149

- 技術補佐員
向井 あすか
(むかい あすか)

- 技術補佐員
田村 政人
(たむら まさと)

- 技術補佐員
服部 良一
(はっとり よしかず)

- 大学院生
川越 聡一郎
(かわごえ そういちろう)

- 大学院生
川向 ほの香
(かわむかい ほのか)

- 大学院生
齋藤 彦太
(さいとう げんた)

- 学生アルバイト
山本 晃平
(やまもと こうへい)

- 学部生
加藤 胡都菜
(かとう ことな)
発表論文
| 【代表論文】 | |
| ・ | Nanaura H., Kawamukai H., Fujiwara A., Uehara T., Aiba Y., Nakanishi M., Shiota T., Hibino M., Wiriyasermkul P., Kikuchi S., Nagata R., Matsubayashi M., Shinkai Y., Niwa T., Mannen T., Morikawa N., Iguchi N., Kiriyama T., Morishima K., Inoue R., Sugiyama M., Oda T., Kodera N., Toma-Fukai S., Sato M., Taguchi H., Nagamori S., Shoji O., Ishimori K., Matsumura H., Sugie K., Saio T. , Yoshizawa T., Mori E. C9orf72-derived arginine-rich poly-dipeptides impede phase modifiers. Nat Commun. 2021 Sep 6;12(1):5301. doi: 10.1038/s41467-021-25560-0. |
| ・ | Saio T. , Hiramatsu S., Asada M., Nakagawa H., Shimizu K., Kumeta H., Nakamura T., Ishimori K. Conformational ensemble of a multidomain protein explored by Gd3+ electron paramagnetic resonance. Biophys J. 2021 Aug 3;120(15):2943-2951. doi: 10.1016/j.bpj.2021.06.033. |
| ・ | Kawagoe, S., Nakagawa, H., Kumeta, H., Ishimori, K., *Saio, T. Structural insight into proline cis/trans isomerization of unfolded proteins catalyzed by the trigger factor chaperone. J. Biol. Chem. 293, 15905-15106, 2018. |
| ・ | *Saio, T., Kawagoe, S., Ishimori, K., *Kalodimos, C.G. Oligomerization of a molecular chaperone modulates its activity. eLife 7, e35731, 2018. |
| ・ | Huang, C., Rossi, P., Saio, T., *Kalodimos, C.G. Structural basis for the antifolding activity of a molecular chaperone. Nature 537, 202-206, 2016. |
| ・ | Saio, T., Ogura, K., Kumeta, H., Kobashigawa, Y., Shimizu, K., Yokochi, M., Kodama, K., Yamaguchi, H., Tsujishita, H., *Inagaki, F. Ligand-driven conformational changes of MurD visualized by paramagnetic NMR. Sci. Rep. 5, 16685, 2015. |
| ・ | Saio, T., Guan, X., Rossi, P., Economou, A., *Kalodimos, CG. Structural basis for protein anti-aggregation activity of the trigger factor chaperone. Science 344, 1250494, 2014. |
| 【上記以外の主要論文】 | |
| ・ | Nakagawa H., Saio T., Nagao M., Inoue R., Sugiyama M., Ajito S., Tominaga T., Kawakita Y. Conformational dynamics of a multidomain protein by neutron scattering and computational analysis. Biophys J. 2021 Aug 17;120(16):3341-3354. doi: 10.1016/j.bpj.2021.07.001. |
| ・ | Okuda A, Inoue R., Morishima K., Saio T., Yunoki Y., Yagi-Utsumi M., Yagi H, Shimizu M., Sato N., Urade R., Kato K., Sugiyama M. Deuteration Aiming for Neutron Scattering. Biophys Physicobiol. 2021 Feb 6;18:16-27. doi: 10.2142/biophysico.bppb-v18.003. eCollection 2021 |
| ・ | Mimura M., Tomita S., Shinkai Y., Hosokai T., Kumeta H., Saio T., Shiraki K., Kurita R. Quadruplex Folding Promotes the Condensation of Linker Histones and DNAs via Liquid-Liquid Phase Separation. J Am Chem Soc. 2021 Jul 7;143(26):9849-9857. doi: 10.1021/jacs.1c03447. |
| ・ | Okumura M., Kanemura S., Matsusaki M., Kinoshita M., Saio T., Ito D., Hirayama C., Kumeta H., Watabe M., Amagai Y., Lee Y.H., Akiyama S., Inaba K. A unique leucine-valine adhesive motif supports structure and function of protein disulfide isomerase P5 via dimerization. Structure. 2021 Apr 9:S0969-2126(21)00114-3. doi: 10.1016/j.str.2021.03.016. |
| ・ | Saio, T., Ishimori, K. Accelerating structural life science by paramagnetic lanthanide probe methods. Biochim. Biophys. Acta. Gen. Subj. 1864, 129332, 2020. |
| ・ | Kamran Rizzolo, Angela Yeou Hsiung Yu, Adedeji Ologbenla, Sa-Rang Kim, Haojie Zhu, Koichiro Ishimori, Guillaume Thibault, Elisa Leung, Yi Wen Zhang, Mona Teng, Marta Haniszewski, Noha Miah, Sadhna Phanse, Zoran Minic, Sukyeong Lee, Julio Diaz Caballero, Mohan Babu, Francis T. F. Tsai, Tomohide Saio & Walid A. Houry. Functional cooperativity between the trigger factor chaperone and the ClpXP proteolytic complex. Nature Commun. 12, 281, 2021. |
| ・ | Taguchi, Y., Saio, T., *Kohda, D. Distance Distribution between Two Iodine Atoms Derived from Small-Angle X-ray Scattering Interferometry for Analyzing a Conformational Ensemble of Heavy Atom-Labeled Small Molecules. J. Phys. Chem. Lett. 11, 5451-5456, 2020. |
| ・ | Yoshizawa, T., Nozawa, R.S., Jia, T.Z., Saio, T., *Mori, E. Biological phase separation: cell biology meets biophysics. Biophys. Rev. 12, 519-539, 2020. |
| ・ | *Okumura, M., Noi, K., Kanemura, S., Kinoshita, M., Saio, T., Inoue, Y., Hikima, T., Akiyama, S., *Ogura, T., *Inaba, K. Dynamic assembly of protein disulfide isomerase in catalysis of oxidative folding. Nat. Chem. Biol. 15, 499-509, 2019. |
| ・ | Nanaura, H., Kawamukai, H., Fujiwara, A., Uehara, T., Nakanishi, M., Shiota, T., Hibino, M., Aiba, Y., Wiriyasermkul, P., Kikuchi, S., Nagata, R., Matsubayashi, M., Nagamori, S., Shoji, O., Ishimori, K., Matsumura, H., Sugie, K., *Saio, T., *Yoshizawa, T., *Mori, E.. Toxic PR poly-dipeptides encoded by the C9orf72 repeat expansion target Kapβ2 and dysregulate phase separation of low-complexity domains. bioRxiv 2019. doi: 10.1101/812099. |
| ・ | Sato, W., Uchida, T., Saio, T., *Ishimori K. Polyethylene glycol promotes autoxidation of cytochrome c. Biochim. Biophys. Acta. Gen. Subj. 1862, 1339-1349, 2018. |
| ・ | Monneau, Y.R., Ishida, Y., Rossi, P., Saio, T., Tzeng, S.R., Inouye, M., *Kalodimos, C.G. Exploiting E. coli auxotrophs for leucine, valine, and threonine specific methyl labeling of large proteins for NMR applications. J. Biomol. NMR 65, 99-108, 2016. |
| ・ | Imai, M., Saio, T., Kumeta, H., Uchida, T., Inagaki, F., Ishimori, K. Investigation of the redox-dependent modulation of structure and dynamics in human cytochrome c. Biochem. Biophys. Res. Commun. 469, 978-84, 2016. |
| ・ | Sato, W., Hitaoka, S., Inoue, K., Imai, M., Saio, T., Uchida, T., Shinzawa-Itoh, K., Yoshikawa, S., Yoshizawa, K., *Ishimori, K. Energetic Mechanism of Cytochrome c-Cytochrome c Oxidase Electron Transfer Complex Formation under Turnover Conditions Revealed by Mutational Effects and Docking Simulation. J. Biol. Chem., 291, 15320-31, 2016. |
| ・ | *Furukawa, Y., Anzai, I., Akiyama, S., Imai, M., Cruz, F.J., Saio, T., Nagasawa, K., Nomura, T., Ishimori, K. Conformational Disorder of the Most Immature Cu, Zn-Superoxide Dismutase Leading to Amyotrophic Lateral Sclerosis. J. Biol. Chem., 291, 4144-55, 2016. |
| ・ | *Ogura, K., Kobashigawa, Y., Saio, T., Kumeta H, Torikai S, Inagaki F. Practical applications of hydrostatic pressure to refold proteins from inclusion bodies for NMR structural studies. Protein. Eng. Des. Sel., 26, 409-416, 2013. |
| ・ | Saio, T., *Kalodimos, C.G. NMR disentangles a dynamic disaggregase machinery. Nat. Struct. Mol. Biol. 20, 409-410, 2013. |
| ・ | Kobashigawa, Y. †, Saio, T. †, Ushio, M. †, Sekiguchi, M., Yokochi, M., Ogura, K., *Inagaki, F. (†Equal contribution) Convenient method for resolving degeneracies due to symmetry of the magnetic susceptibility tensor and its application to pseudo contact shift-based protein-protein complex structure determination. J. Biomol. NMR, 53, 53-63, 2012. |
| ・ | Saio, T., Ogura, K., Shimizu, K., Yokochi, M., Burke, T.R. Jr., *Inagaki, F. An NMR strategy for fragment-based ligand screening utilizing a paramagnetic lanthanide probe. J. Biomol. NMR, 51, 395-408, 2011. |
| ・ | Saio, T., Yokochi, M., Kumeta, H., *Inagaki, F. PCS-based structure determination of protein-protein complexes. J. Biomol. NMR, 46, 271-280, 2010. |
| 【書籍】 | |
| ・ | *Saio, T., Fuyuhiko Inagaki. Structural Study of Proteins by Paramagnetic Lanthanide Probe Methods. Springer, In: Experimental approaches of NMR spectroscopy -Methodology and application to life science and materials science-, Chapter 8, 227-252, 2017. |
| ・ | Saio, T., *Inagaki, F.. Structural biology with advanced NMR technique. Springer, In: Advanced Methods in Structural Biology, Chapter 17, 315-340, 2016. |
| 【主要な和文総説】 | |
| ・ | *小田 隆,齋尾 智英, 検出技術:天然変性タンパク質の構造生物学, In: 特集 相分離生物学:相分離メガネのススメ, 生物工学会誌, 98, 228-254, 2020 |
| ・ | *斉尾 智英, 石森 浩一郎. 立体構造から明らかにする分子シャペロンの作用機序. 生物物理, 59, 197-201, 2019. |
| ・ | *児玉 耕太, 斉尾 智英, 前仲 勝実, 金城 政孝. WetとDryのコミュニケーションによるアカデミア創薬. バイオサイエンスとインダストリー, 75, 323-325, 2017. |
| ・ | *斉尾 智英トリガーファクターシャペロンによる動的基質認識の構造基盤.生化学, 88, 406-610, 2016. |
| ・ | *斉尾 智英, Charalampos G. Kalodimos. トリガー因子は変性状態のタンパク質とのダイナミックな相互作用により凝集を抑制する. ライフサイエンス 新着論文レビュー, 10.7875/first.author.2014.065, 2014. |
リンク集
次世代NMRワーキンググループ
https://nextnmr.jp/
北海道大学 先端NMRファシリティ
https://altair.sci.hokudai.ac.jp/facility/nmr/
北海道大学NMR測定室
http://protein.pharm.hokudai.ac.jp/nmr2021/index.php
学術変革領域研究(B)「遅延制御超分子化学」
https://web.tohoku.ac.jp/KineticControl/














